Огонь, вода и медные трубы или эволюция латунной сантехники
Содержание:
- Цинковый сплав в бижутерии
- Причины появления коррозии
- Историческая справка, характеристика меди
- Окисленная медная руда
- Влияние воды
- Числовой эквивалент стойкости к точечной коррозии (PREN)
- Кабели из катодной меди: применение
- Плюсы и минусы
- Олово и цинк
- Условия разрушения материала
- Правила ухода
- Коррозия меди в кислых средах
- Химические свойства хрома
- Коррозия и поверхностная обработка нержавеющей стали
- Коррозионные свойства
- Разновидности цинковых сплавов
- Как алюминий защищен от коррозии?
- Получение цинка
Цинковый сплав в бижутерии
Внешне цинковые сплавы напоминают благородные металлы. Поэтому их используют в бижутерии для создания недорогих украшений. Бижутерия из цинкового сплава выглядит дорого, но легко создается.
Вреден ли цинковый сплав? На самом деле, он никак не влияет на организм человека. Но, тем не менее, лучше приобретать бижутерию хорошего качества. Обычно для создания украшений используется особый сплав, который так и называется – бижутерный. Чаще всего применяется латунь или сплав с алюминием. Внешне такие изделия напоминают золотые и серебряные.
Вреден ли цинковый сплав в бижутерии? Нет, поэтому изделия из него можно смело покупать. Ведь если бы он негативно воздействовал, изготовление украшений из него было бы запрещенным.
Таким образом, цинк и цинковые сплавы широко распространены. Их используют в медицине, автомобилестроении и даже в бижутерии. Это качественные и устойчивые материалы, которые практически не меняются под воздействием условий окружающей среды.
Причины появления коррозии
Когда встает вопрос о том, ржавеет ли алюминий, необходимо задуматься о причинах, приводящих к коррозии. Различные внешние факторы могут ускорять этот процесс. Причины появления ржавчины на алюминии могут быть следующими:
Взаимодействие с какой-либо кислотой или щелочью.
Механическое давление. Например, трение или сильный удар, после чего появляется царапина на верхнем слое металла.
Существуют промышленные районы. В них продукты распада топлива влияют на оксидную пленку и разрушают ее. Металл начинает портиться. Аналогичная ситуация происходит в мегаполисах, где продукты распада топлива будут взаимодействовать с серой, а также с оксидами углерода. Подобный процесс разрушает пленку на алюминии. После такого рода внешнего воздействия алюминий подвергается коррозии.
Следует помнить, что хлор, фтор, а также бром и натрий могут растворить защитный слой металла.
Если на металл попадают строительные смеси, то он начинает быстро портиться. В данном случае на алюминий неблагоприятно воздействует цемент.
Ржавеет ли алюминий от воды? Если она попадает на лист, то металл может быть подвержен коррозионным процессам
Важно при этом уточнить, какая жидкость оказывает воздействие. Многие используют специальный сплав, который не подвержен коррозии от воды
Его называют дюралюминием. Уникальный сплав используют вместе с медью, а также с марганцем.
Историческая справка, характеристика меди
Медь относится к отряду основных химических элементов. В естественном (чистом) виде это металл с красно-оранжевым оттенком. Его используют для изготовления очень большого ряда изделий, к которым относятся провода электрические, посуда, трубы, радиаторы автомобилей и т. п.
Информация археологов говорит о том, что медь начали использовать более десяти тысяч лет назад. Так медный кулон, обнаруженный в северных районах современного Ирака, был изготовлен около 8700 года до нашей эры.
Медь обладает высокими показателями тепловой и электрической проводимости, легко обрабатывается как горячим, так и холодным способом. У нее очень высокая коррозийная стойкость. Это обусловлено тем, что медь создает на своей поверхности очень тонкий оксидный защитный слой в результате реакции ее с кислородом.
Медь нашла широкое применение в производстве акустических, электрических и иных проводов, присутствуя там как металл высокой чистоты либо с небольшими добавлениями серебра, мышьяка, фосфора, теллура, серы.
Окисленная медная руда
Окисленные медные руды плохо подвергаются обогащению, поэтому их перерабатывают преимущественно гидрометаллургическими способами.
Окисленные медные руды ( медный блеск, лазурит, малахит) с содержанием меди от 15 до 45 % брикетировали с добавками глины, слабо обжигали, после чего выщелачивали раствором Ре2 ( 8О4) з и подвергали электролизу со свинцовыми анодами. Отработанный раствор, обогащенный кислотой, вновь возвращался на выщелачивание.
Окисленные медные руды плохо подвергаются обогащению, поэтому их перерабатывают преимущественно гидрометаллургическими способами.
Бедные окисленные медные руды или смешанные окисленносуль-фидные руды трудно подвергаются обогащению и их перерабатывают гидрометаллургическим путем. Технологический процесс состоит из трех операций: выщелачивания руды, приготовления электролита и электролиза. Для выщелачивания руды применяют либо метод перколяции, либо кучное выщелачивание, подземное выщелачивание или выщелачивание пульпы в агитаторах. Полученные растворы подвергают очистке обработкой их известняком. При этом железо и алюминий выделяются в виде гидроксидов, которые адсорбируют примеси мышьяка, сурьмы и фосфора. Для удаления примесей азотной кислоты и других часть раствора выводят в отвал, предварительно выделив из него медь цементацией. К чистому раствору CuSO4 добавляется H2S04, и электролит направляют на электролиз с нерастворимым анодом, в качестве которого применяют сплавы свинца с серебром или сурьмой. Катодами являются медные листы, полученные в матричных ваннах. Электролизеры работают по каскадной схеме.
Различают сернистые и окисленные медные руды. Медь встречается в природе и в самородном виде.
|
Марки меди и содержание примесей. |
Для переработки окисленных медных руд применяют гидрометаллический метод, который заключается в выщелачивании меди из руды и осаждении ее из раствора.
Медь получают из сульфидных и окисленных медных руд. Около 80 % меди добывают из сульфидных руд и примерно 20 % — из окисных.
Медь получают из сульфидных и окисленных медных руд. Около 80 % меди добывают из сульфидных руд и примерно 20 % — из окисных.
Для производства меди используют сульфидные и окисленные медные руды.
|
Прожилки асбеста в породе. Баженовское месторождение. Урал. |
Зеленые силикаты никеля сходны с окисленными медными рудами — землистым малахитом, хризоколлой, от которых отличаются окраской, характером агрегатов и химическими реакциями.
Разработаны также сорбционные процессы для извлечения меди из окисленных медных руд и растворов после кучного или подземного выщелачивания с использованием ионообменных материалов, которые также позволяют получать медь в виде катодов или порошков.
В настоящее время практикуется получение меди путем растворения подземных окисленных медных руд в разбавленной серной кислоте с дальнейшим выделением меди из раствора электролизом.
В древние времена выплавка меди базировалась на использовании исключительно богатых окисленных медных руд ( с содержанием меди не ниже 20 %) благодаря чрезвычайной простоте технологической переработки этих руд.
Влияние воды
Коррозия меди в воде и скорость протекания процесса будет зависеть от наличия оксидной пленки и объема растворенного в ней кислорода. Как правило, протекает ударный или точечный процесс. При этом скорость будет тем быстрее, чем большее количество кислорода содержится в воде. Также негативно будет влиять жидкость с содержанием ионов хлора и низким уровнем pH.
В общем сопротивление поверхности коррозийным воздействиям достаточно высоко, чему способствует наличие оксидной пленки, не позволяющая разрушающим элементом проникать в структуру металла. Слой оксида будет возникать при нахождении металла более 2 месяцев постоянного пребывания в воде. Оксидное покрытие может быть двух типов:
- · Карбонат – зеленого оттенка. Принято считать наиболее прочным.
- · Сульфат – темного цвета. Обладает рыхлой структурой и меньшей прочностью.
Металл часто используется при производстве различных трубопроводов. Однако, если протекающая по ним жидкость имеет контакт с алюминием, цинком, железом, то она значительно ускоряет их коррозию. Чтобы это предотвратить и защитить медь от коррозии опять же проводится лужение оловом.
Числовой эквивалент стойкости к точечной коррозии (PREN)
Показатель RREN относится к справочным, он показывает склонность разных видов и марок нержавейки к появлению питтингов. Числовой эквивалент стойкости к точечной коррозии применяют как ориентир, но не как абсолютное руководство для предопределения коррозионной стойкости.
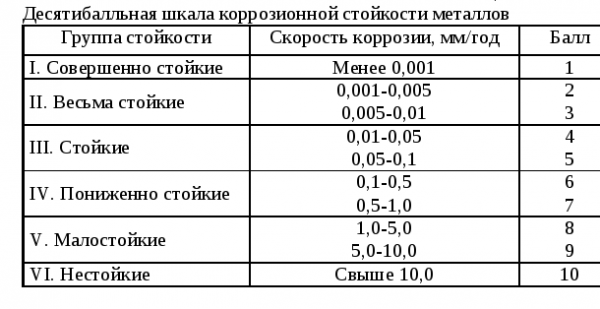
Обычно наиболее устойчивыми к точечному ржавлению оказываются молибден, хром и азот в качестве добавок при легировании. Чем выше цифра RREN, тем более стойкой будет сталь к появлению питтингов. Вот справочная информация по RREN:
| Марка стали | RREN |
|---|---|
| 444 | 25 |
| 430 | 16 |
| 304 | 19 |
| 316 | 26 |
| 304LN | 21 |
| 904L | 36 |
| 316LN | 27,5 |
| SAF 2507 | 42 |
| Zeron 100 | 41 |
Кабели из катодной меди: применение
Современная кабельная продукция, сделанная с использованием бескислородной меди, отличается повышенной проводимостью. Это дает возможность осуществлять высокую пропускную способность электрических сигналов при меньших сечениях проводов.
Однако стоит отметить, что широкого использования кабели из бескислородной меди не нашли. А все потому, что провода из этого металла отличаются высокой стоимостью. Для достижения нужных параметров используют простые медные с большим диаметром, предпочитая не тратиться на дорогие изделия из бескислородной меди.
Но есть и области, в которых предпочтение отдается высокой проводимости в сочетании с небольшим диаметром проводов. Это необходимо для обеспечения в том числе эстетичного вида. К таким сферам относятся производство музыкального оборудования, качественных наушников, а также те, где надо получить устройства, воспроизводящие высококачественные звуки профессионального уровня.
При применении такой меди отмечаются ее достоинства в противостоянии внутренней коррозии. Благодаря этому свойству провода из бескислородной меди со временем характеристик своих не теряют. По этой причине кабели с начинкой из этого металла используют в условиях, где присутствует высокая влажность.
Плюсы и минусы
Большинство цинковых сплавов имеют следующие преимущества:
- они очень прочные, не повреждаются при механических воздействиях;
- устойчивы к коррозии;
- имеют хорошие литейные качества, могут использоваться для создания даже мелких элементов;
- со временем практически не подвергаются старению.
Однако примеси даже в незначительном количестве ухудшают характеристики сплава. Приводят к снижению жидкоплавкости, к набуханию, способствуют появлению трещин. Поэтому цинковые сплавы должны создаваться с соблюдением всех технологий, а количество примесей в них не должно превышать 0,005%.
Многие спрашивают, темнеют или нет цинковые сплавы? В этом еще один недостаток материала. Цинковые сплавы могут темнеть с течением времени. Притом потемнения обычно распространяются на всю поверхность материала. Это обуславливается образованием оксидной пленки на поверхности материала. Она формируется при комнатной температуре после контакта с воздухом или водой. Поэтому во избежание этого требуется нанесение гальванических покрытий.
Олово и цинк
Данный сплав не менее популярен, чем другие, уже рассмотренные нами ранее. В 1917-1918-х годах в Болгарии он широко использовался для изготовления специальных сосудов, которые держали теплую жидкость долгое время (аналоги современных термосов). В наше время сплав цинк-олово очень широко используется в радио- и электропромышленности. Это связано с тем, что состав с содержанием Zn 20% очень хорошо паяется, и полировка осадка сохраняется продолжительное время.
Конечно же, как антикоррозионное покрытие данный сплав также может быть использован. По своим характеристикам он очень похож на кадмиевое покрытие, но при этом менее дорогостоящий.
Условия разрушения материала
Несмотря на устойчивость к порче, даже медные изделия при определенных условиях могут ржаветь. Меньше всего подобные явления выражены во влажном воздухе, воде, почве, больше – в кислой среде.
Серьезно снизить коррозию можно путем лужения – покрытия меди слоем олова. Качественное лужение дает надежную защиту от повреждений, повышает коррозионную стойкость, делает материал не подверженным действию высоких температур, дождя, града, снега. Срок службы луженых изделий составляет более 100 лет без потери первоначальных свойств.

Влияние воды
Скорость коррозии меди в воде сильно зависит от наличия оксидной пленки на ее поверхности, а также от степени насыщенности воды кислородом. Чем больше содержание последнего, тем интенсивнее протекает разрушение материала. В целом, медь считается стойкой к вредному воздействию соленой и пресной воды, и пагубно влияют на нее только растворенные ионы хлора, низкий уровень pH. Прочность, неподверженность ржавлению позволяет применять материал для изготовления трубопроводов.
Если на поверхности изделия, покрытого медью, имеется коричневая или зеленая оксидная корка, разрушающие вещества в малой степени проникают внутрь. Обычно оксидный слой формируется спустя 60 дней нахождения металла в воде. Более прочной считается зеленая корка (карбонатная), рыхлой и менее крепкой – черная (сульфатная).
В морской воде уровень коррозии практически такой же, как и в пресной. Лишь при ускорении движения жидкости коррозия становится ударной, поэтому – более интенсивной. Медь – материал, который не способен обрастать морскими микроорганизмами, ведь его ионы губительны для моллюсков, водорослей. Это свойство металла используется в судоходстве, рыбном хозяйстве.

Воздействие кислот и щелочей
В щелочах медь не портится, ведь материал сам по себе является щелочным, зато кислоты для нее являются самыми пагубными по воздействию. Наиболее значимая и быстрая коррозия происходит при контакте с серой и ее кислотными соединениями, а азотная кислота и вовсе полностью разрушает структуру материала.
В концентрированных кислотах медь растворяется, поэтому при изготовлении оборудования для нефтегазовой промышленности требует дополнительной защиты. С этой целью применяются ингибиторы – замедлители химических реакций:
- Экранирующие – формируют пленку, которая не позволяет кислотам достигать медной поверхности.
- Окислительные – превращают верхний слой в окись, которая будет вступать в реакцию с кислотами без вреда для самого металла.
- Катодные – увеличивают перенапряжение катодов, чем замедляют реакцию.
Коррозия в почве и влажном воздухе
В почве проживает множество микроорганизмов, которые вырабатывают сероводород, поэтому среда тут кислая, скорость коррозии меди возрастает. Чем более отклонено значение pH в сторону закисления, тем быстрее протекают процессы разрушения. Если грунт насыщен кислородом, металл окисляется, но ржавеет меньше. При длительном нахождении медных изделий в земле они зеленеют, становятся рыхлыми и могут даже рассыпаться. Краткосрочное пребывание в почве вызывает появление патины, от которой предмет можно очистить.
Влажный воздух плохо сказывается на состоянии материала только при долгом контакте, а вначале тоже вызывает появление патины (оксидного слоя). Исключение составляет пар, насыщенный хлоридами, сульфидами, углекислотой – в нем коррозия развивается стремительнее.
Правила ухода
Девушки хотят, что бы украшение прослужило как можно дольше, поэтому задаются вопросом: как сохранить его внешний вид? Не допускать контакта с агрессивными средствами. К ним относят мыло, моющие составы, шампунь, гель для душа и другие химические вещества. Даже вода отрицательно влияет на вид изделия.
Также не рекомендуется наносить парфюм и дезодорант. Духи лучше наносить подальше от цепочки из такого металла, иначе она быстро потеряет свой вид.
Темнеет ли бижутерный сплав?
Все зависит от состава, которым он был покрыт. Металл темнеет от влияния внешней среды и исключением является только гальваническое покрытие, которое отличается высокой стойкостью.
Как очищать украшения?
Для очищения украшений необходимо использовать мягкую тряпочку или салфетку. При этом не стоит использовать мыло или другие средства. Достаточно снять изделие и протереть его со всех сторон. Такую процедуру можно проводить один раз в несколько дней.
Украшения из бисера или стекла можно очищать при помощи теплой воды с мыльным раствором.
Как хранить?
Лучше всего хранить каждое изделие в небольшом мешочке. Часто они идут в комплекте к украшению. Иначе возможна химическая реакция между разными металлами. Не стоит хранить в одной шкатулке с серебром или золотом.

Коррозия меди в кислых средах
Медь проявляет хорошую устойчивость к коррозии в любых условиях, так как нечасто вытесняет водород, потому что она в электрохимическом ряду напряжений стоит около благородных металлов. Широкое использование меди в химической промышленности вызвано ее стойкостью ко многим агрессивным органическим средам:
- нитратам и сульфидам;
- фенольным смолам;
- уксусной, молочной, лимонной и щавелевой кислоте;
- гидроокиси калия и натрия;
- слабым растворам серной и соляной кислоты.
С другой стороны, отмечается сильное разрушение меди в:
- кислых растворах солей хрома;
- минеральных кислотах — хлорной и азотной, причем коррозия усиливается с увеличением концентрации.
- концентрированной серной кислоте, усиливаясь при повышении температуры;
- гидроокиси аммония;
- окисляющих солях.
Химические свойства хрома
Хром — элемент VIB группы таблицы Менделеева. Электронная конфигурация атома хрома записывается как 1s 22s 22p 63s 23p63d54s1, т.е. в случае хрома, также как и в случае атома меди, наблюдается так называемый «проскок электрона»
Наиболее часто проявляемыми степенями окисления хрома являются значения +2, +3 и +6. Их следует запомнить, и в рамках программы ЕГЭ по химии можно считать, что других степеней окисления хром не имеет.
При обычных условиях хром устойчив к коррозии как на воздухе, так и в воде.
Взаимодействие с неметаллами
с кислородом
Раскаленный до температуры более 600 oС порошкообразный металлический хром сгорает в чистом кислороде образуя окcид хрома (III):
4Cr + 3O2 =ot=> 2Cr2O3
с галогенами
С хлором и фтором хром реагирует при более низких температурах, чем с кислородом (250 и 300 oC соответственно):
2Cr + 3F2 =ot=> 2CrF3
2Cr + 3Cl2 =ot=> 2CrCl3
С бромом же хром реагирует при температуре красного каления (850-900 oC):
2Cr + 3Br2 =ot=> 2CrBr3
С азотом металлический хром взаимодействует при температурах более 1000 oС:
2Cr + N2 =ot=> 2CrN
с серой
С серой хром может образовывать как сульфид хрома (II) так и сульфид хрома (III), что зависит от пропорций серы и хрома:
Cr + S =ot=> CrS
2Cr + 3S =ot=> Cr2S3
С водородом хром не реагирует.
Взаимодействие со сложными веществами
Взаимодействие с водой
Хром относится к металлам средней активности (расположен в ряду активности металлов между алюминием и водородом). Это означает, что реакция протекает между раскаленным до красного каления хромом и перегретым водяным паром:
Взаимодействие с кислотами
Хром при обычных условиях пассивируется концентрированными серной и азотной кислотами, однако, растворяется в них при кипячении, при этом окисляясь до степени окисления +3:
В случае разбавленной азотной кислоты основным продуктом восстановления азота является простое вещество N2:
Хром расположен в ряду активности левее водорода, а это значит, что он способен выделять H2 из растворов кислот-неокислителей. В ходе таких реакций в отсутствие доступа кислорода воздуха образуются соли хрома (II):
При проведении же реакции на открытом воздухе, двухвалентный хром мгновенно окисляется содержащимся в воздухе кислородом до степени окисления +3. При этом, например, уравнение с соляной кислотой примет вид:
4Cr + 12HCl + 3O2 = 4CrCl3 + 6H2O
При сплавлении металлического хрома с сильными окислителями в присутствии щелочей хром окисляется до степени окисления +6, образуя хроматы:
Коррозия и поверхностная обработка нержавеющей стали
Удаление коррозии можно произвести химическим способом – использовать специальные преобразователи ржавчины. Также поверхность изделий из нержавейки разрешается обрабатывать путем фрезерования, зачистки, шлифовки, полировки. Выбор конкретной методики зависит от предпочтений специалиста и ряда иных условий.
Подбор способа профилактической обработки металла будет обусловлен начальной коррозионной стойкостью конкретной марки стали. На шероховатых поверхностях чаще формируются элементы точечной коррозии, а на гладких пятна ржавчины появляются редко. Марки 304, 316 при использовании в условиях морской воды быстро ржавеют, их нужно защищать более тщательно.
Коррозионные свойства
В сухом воздухе образуется тонкая оксидная пленка, толщина которой составляет около 50 нм. В пресной воде скорость коррозии металла составляет 0,05–0,25 мм/год. Однако при содержании в жидкости аммиака, сероводорода, хлоридов и некоторых других примесей интенсивность коррозионного процесса возрастает.
В морской воде коррозия меди незначительна, и интенсивность ее соизмерима с разрушением в пресной. Однако при увеличении скорости движения среды возникает ударная коррозия, что приводит к повышению скорости процесса. Коррозия меди существенно зависит от температуры, и при возрастании последней скорость разрушения увеличивается.
Медь является единственным материалом, который не подвержен обрастанию водорослями, так как ее ионы губительно действуют на них. В почве, насыщенной микроорганизмами, скорость коррозионных процессов заметно возрастает. Интенсивность их протекания напрямую зависит от pH грунта. Чем больше отклонение значения показателя от нейтрального, тем быстрее происходит коррозия металла. Влияние микроорганизмов на процесс разрушения обуславливается выделением сероводорода в результате их жизнедеятельности.
Продукты почвенной коррозии элемента отличаются от атмосферной, имеют более сложный состав и структуру.
Коррозия меди, покрытой слоем олова (луженой), практически отсутствует. При качественном лужении она прекрасно служит под воздействием града и снега, становится нечувствительной к перепаду температур. Срок службы таких материалов составляет около 100 лет. При этом не теряются первоначальные свойства. Со временем цвет не изменяется, а остается первоначальным — серебристо-металлическим. Луженая медь прекрасно показала себя в качестве кровельного материала. Ведь не зря купола многих храмов покрывают именно этим материалом.
 Медь хорошо зарекомендовала себя в кровле.
Медь хорошо зарекомендовала себя в кровле.
Из-за высокой коррозионной устойчивости к воздействию многих агрессивных сред медь нашла широкое применение в химической промышленности.
 Устойчивый металл широко используется в химической промышленности.
Устойчивый металл широко используется в химической промышленности.
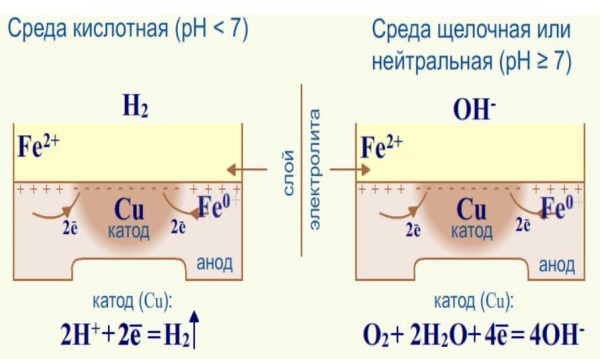
В гальванической паре она является катодом для большинства металлов и сплавов и в результате электрохимических процессов при контакте с ними вызывает их ускоренную коррозию.
Разновидности цинковых сплавов
Цинк могут сплавлять с различными веществами, отчего будут зависеть свойства полученного материала. Сплавление чистого цинка с медью, алюминием и оловом может улучшить его характеристики. Полученный состав будет более качественным, нежели чистое вещество.
Медь и цинк
Медно-цинковый сплав называется латунью. Такой сплав известен уже очень давно. Сначала его изготавливали посредством сплавления цинковой руды и меди. И только в 18 веке впервые был создан сплав из меди и металлического цинка.
Притом оба компонента могут брать в разных пропорциях. В результате этого отличают несколько разновидностей латуни:
- Зеленая. Содержит 60% меди и 40% цинка.
- Золотистая. В ее состав входит 75% меди и 25% цинка.
- Желтая. Содержит 67% меди и 33% цинка.
 Латунь – сплав меди и цинка
Латунь – сплав меди и цинка
Латунь отлично поддается обработке давлением. Характеризуется высокими механическими свойствами, неплохой коррозионной устойчивостью. Но на воздухе, в соленой воде и углекислых растворах латунь неустойчива, быстро покрывается темной кислородной пленкой.
Внешне латунь выглядит красивее меди, характеризуется лучшей коррозионной стойкостью. Но с ростом температуры интенсивность коррозии также увеличивается. Ее могут спровоцировать повышенная влажность воздуха, наличие в нем аммиака или сернистого газа. Поэтому для предотвращения коррозии материал подвергают низкотемпературному обжигу.
Латуни не теряют своих свойств при понижении температуры. Это позволяет использовать их, как конструкционный материал. Но при высоких температурах (более 200 градусов) могут наблюдаться явления хрупкости латуни.
Олово и цинк
Сплав цинка с оловом характеризуется высокими защитными свойствами. Ржавеет или нет цинковый сплав с оловом? Такой материал получается очень устойчивым к коррозии. Самыми лучшими антикоррозионными свойствами обладает сплав с 20-25% цинка и 75-80% олова. Поэтому его можно применять в условиях высокой влажности, со временем его внешний вид не ухудшится. Чем выше содержание цинка в сплаве, тем ниже его коррозионная устойчивость. Если сплав содержит 50% и более цинка, его корозионная стойкость приближена к стойкости чистого цинка.
Сплав олова с цинком обладает следующими преимуществами:
- Он очень пластичен, хорошо подается пайке.
- Полировка осадка сохраняется на протяжении долгого времени.
- Имеет высокую коррозионную стойкость.
За счет наличия вышеперечисленных свойств сплав олова и цинка обычно применяют в электро- и радиопромышленности. Изделия из него получаются очень прочными и устойчивыми к внешним воздействиям.
Алюминий и цинк
Чаще всего создается сплав из цинка, алюминия и меди, который называют ЦАМ. Также в его состав входит небольшое количество магния.
Такой сплав имеет небольшую температуру плавления, хорошо подается литью. Изделия из него получаются очень прочными и устойчивыми к окружающей среде.
Есть несколько качественных сплавов цинка с алюминием, которые обозначаются через ЦАМ 4-1, ЦАМ 4-3, ЦАМ 10-5 и другие. Они содержат примерно одинаковое количество алюминия, но разное – магния, никеля и меди. Стоимость сплава алюминия с цинком ниже, чем олова с цинком. Поэтому изделия из него стоят в разы дешевле.
Как алюминий защищен от коррозии?
Сплавы других металлов подвержены появлению ржавчины. Она проявляется достаточно быстро. Если создать для алюминия определенные условия, то он не будет разрушаться долгие годы. Для защиты алюминия от коррозии на нем образуется специальная пленка. Она ложится тонким слоем, который составляет от 3 до 30 нанометров. Состоит подобное покрытие из оксида алюминия.
Пленка является прочной и дает металлу дополнительную защиту от внешних негативных воздействий. Благодаря такому слою воздух и влага не попадают в структуру материала. Если целостность оксидного покрытия нарушается, то начинается процесс коррозии алюминия. Металл теряет свои свойства.

Получение цинка
Первый — электролитический, основывается на обработке оксида цинка серной кислотой. В результате этой реакции образовывается сульфатный раствор, который очищают от примесей и подвергают электролизу. На алюминиевых катодах осаживается цинк, который затем плавят в индукционных печах. Чистота цинка, полученного таким образом, составляет около 99,95%.
Второй способ, наиболее давний — дистилляционный. Концентраты нагревают до очень высокой температуры (около 1000°С), выделяются пары цинка, которые путем конденсации оседают на глиняных сосудах. Но этот способ не дает такой чистоты, как первый. В полученных парах содержится около 3% различных примесей, включая такой ценный элемент, как кадмий. Поэтому дальше Zn очищают ликвацией. При температуре 500°С его отстаивают некоторое время и получают чистоту 98%. Для дальнейшего изготовления сплавов этого достаточно, ведь потом цинк все равно легируют этими же элементами. Если этого недостаточно, применяют ректификацию и получают цинк с чистотой 99,995%. Таким образом, оба способа позволяют получить высокочистый цинк.